概述在多種用於異源蛋白表達的系統和培養模式中,治療性抗體藥物的產業化製備始終以哺乳動物細胞大規模培養製程為主。其中中國倉鼠卵巢(CHO)細胞是用於治療性單克隆抗體生產的主要宿主,2016 年至今獲批上市的治療性抗體藥物全部為CHO細胞來源。但是在目前占主導地位的饋料批次培養製程中CHO細胞的新陳代謝遠未達到理想和最優狀態,其培養製程的建立需要大量的專業知識以及製程優化和過程監控。
培養過程中具有毒性和抑制生長的代謝產物的產生和積累,是造成這種情況的主要原因之一。 在這些代謝產物中以乳酸和氨最具代表性,本文將就 CHO 細胞饋料批次培養中乳酸代謝的情況進行簡單整理,包括培養過程中乳酸的生成和消耗,乳酸代謝轉移發生的機制,影響和調控因素及其在製程開發中的應用。
(一)饋料批次培養中 CHO 細胞的生長及糖代謝特點體外培養 CHO 細胞的代謝通常以效率低下和次優為特點,特徵是高效率吸收培養基中的葡萄糖和穀氨醯胺等底物作為碳源和氮源。
作為主要碳源的葡萄糖被細胞吸收並磷酸化為 6 磷酸葡萄糖(G6P),用於糖酵解生成三磷酸腺苷(ATP),還原型煙醯胺腺嘌呤二核苷酸(NADH)和丙酮酸。丙酮酸可以通過三羧酸迴圈徹底氧化為二氧化碳和水,釋放大量能量供細胞利用;也可以通過乳酸脫氫酶A(DHA)的作用與 NADH 的氧化一起轉化為乳酸。其中 35-70%的葡萄糖轉變為代謝廢物如乳酸,並對細胞培養性能發生不同程度的影響。
CHO 細胞饋料批次培養中的生長通常可以分為三個主要階段,即以細胞密度大幅度增加為主的
對數生長期,細胞密度趨於穩定的
穩定期,以及細胞密度和活率持續下降的
凋亡期。
不同生長階段 CHO 細胞的代謝在很多方面會發生明顯變化,在這些代謝變化中乳酸從生成到消耗的轉移,是對饋料批次培養具有較大影響的是一個關鍵事件,與批次培養週期的延長、最終產物產量的提高等關係密切。
(二) CHO 細胞流饋料次培養中的乳酸代謝及其代謝轉移乳酸是目前發現的 CHO 細胞培養中主要毒性代謝產物之一,可以引起培養環境的酸性變化,為了維持培養環境的酸堿恒定,需要通過補充鹼性物質對 pH 進行調節,而堿劑的補充則會引起滲透壓升高,抑制細胞生長,誘導細胞凋亡從而降低重組治療產品的生產率,某些情況下也會影響抗體產物的品質。
饋料批次培養中乳酸代謝通常會分為兩個不同階段:
對數期在細胞快速生長的對數期,葡萄糖通過不完全氧化代謝滿足細胞快速增殖中對 ATP和脂肪酸的需求,葡萄糖的快速消耗伴隨著乳酸的大量產生。
穩定期隨著細胞由快速生長進入穩定期,乳酸由生成轉變為消耗。乳酸從生成到消耗的代謝轉變,通常可以作為饋料批次培養製程中細胞代謝效率的標誌。
目標蛋白的高表達量與細胞培養中後期乳酸的代謝轉移呈強烈的正相關。缺乏有效的代謝轉移調控手段,是導致製程可變性增加的主要因素之一。加強對乳酸代謝的理解對於基於哺乳動物細胞培養的生物製程具有重要指導意義。當細胞快速增殖被突然打斷,糖酵解通量降低,及細胞外乳酸濃度升高等外部條件都可以觸發這種代謝轉移的發生。
(三) 乳酸代謝及其代謝轉移的影響及調節因素饋料批次培養中細胞代謝的影響因素及調節策略很多,包括遺傳水準的影響及干預,細胞培養基組分的影響及調節,補料策略及培養環境的理化因素等。
01遺傳水準的干預從遺傳水準對哺乳動物細胞培養中的乳酸代謝進行干預,是指基於細胞培養中的代謝通量研究和轉錄組學、代謝組學的結果,利用基因工程手段對代謝通路中的關鍵酶,進行基因水準的調整,製備出代謝特性改善的宿主細胞系。
通過轉錄組學及代謝通量研究發現,代謝轉移時細胞能量代謝相關的酶下調,但是還不足以由此引起代謝轉移。細胞外的高乳酸濃度,可以抑制糖酵解途徑的關鍵酶磷酸果糖激酶的活性,降低糖酵解代謝通量,促進乳酸向丙酮酸的轉化。在培養的後期,糖酵解活性調節的AKT1和P53信號通路的轉錄水準發生變化。
● 以往針對乳酸代謝調整的細胞工程化加工,重點集中在宿主細胞的固有基因的調節。
包括降低細胞乳酸脫氫酶的表達水準,促進丙酮酸進入線粒體;通過細胞轉運器調節細胞利用葡萄糖或葡萄糖替代物的能力;部分抑制乳酸脫氫酶A的基因,降低乳酸的產生以及葡萄糖的消耗,從而改善細胞生長;同時調節乳酸脫氫酶和3-磷酸甘油脫氫酶活性,改善細胞生長和表達;增加丙酮酸脫氫酶激酶活性減少乳酸積累並增加抗體產量等等。
● 近年來開始嘗試在細胞中引入外源基因,對乳酸代謝特性進行調節。
例如重組酵母丙酮酸羧化酶(Recombinant yeast pyruvate carboxylase PYC2)。
研究發現,穩定表達外源 PYC2 的 CHO 細胞來源的單抗表達克隆,在培養中傾向于向乳酸消耗的顯著和系統性代謝轉變,可有效延長細胞培養的對數生長期,提高細胞峰密度,進而增加抗體產物的表達量,見圖 1。
即使在高葡萄糖水平下,表達PYC2的CHO細胞克隆,在饋料批次培養中也能保持高效的代謝特性,從而降低了在細胞培養製程中為了避免乳酸堆積,而不得不將葡萄糖濃度控制在較低水準的必要,而因此減輕了培養中維持低水準葡萄糖對抗體產品糖基化的潛在負面影響。
在DG44細胞中引入丙酮酸羧化酶(hPC)基因,也可以導致乳酸生成的減少。此外,抗細胞凋亡基因可顯著改變CHO細胞的乳酸代謝,誘導向乳酸消耗的代謝轉變,並使最終抗體產量提高。
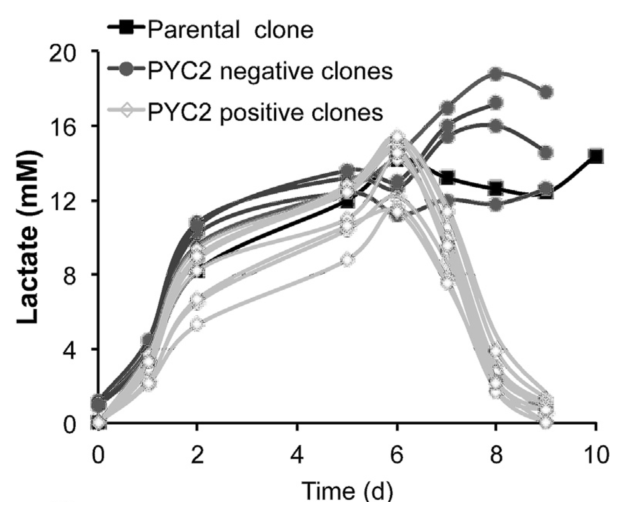
圖 1 外源酵母丙酮酸羧化酶2(PYC2)陽性克隆乳酸代謝改善明顯
02細胞培養基成分及補料策略用於 CHO 細胞培養的無血清培養基通常富含葡萄糖和穀氨醯胺,是支援細胞快速生長所必需的,與永生化細胞中底物的部分氧化的代謝特性相關。即使有足夠的氧氣供應,葡萄糖依然通過部分氧化轉化為乳酸,而不是完全氧化為 CO2 和 H2O。
- 因此可以通過使用代謝相對緩慢的碳源替代培養基中的葡萄糖和穀氨醯胺,比如利用果糖、麥芽糖和半乳糖替代葡萄糖,谷氨酸替代穀氨醯胺來減緩乳酸的積累。
- 對於乳酸堆積傾向較嚴重的細胞克隆,也可以通過控制培養體系中的葡萄糖濃度,比如將葡萄糖水平控制在<0.2 mM;或按照培養環境 pH 監測回饋,進行補糖等方法來避免或減輕乳酸堆積。
- 另外在培養基添加硫酸銅也可以有效緩解乳酸堆積,尤其在葡萄糖過量的情況下。
在培養過程中適時、適當和安全的營養補充策略的建立非常重要。不同的細胞類型甚至相同來源的細胞克隆,都可能有各自不同的代謝特點及合適的補料策略 。從乳酸代謝的角度,補料策略可以著眼於代謝限制,比如限制碳源的補充;可以通過即時或線上監測細胞代謝及營養物質消耗情況指導補料策略。比如圖 2 和圖 3 所示的案例中,以 ActiPro 作為基礎培養基,由於該克隆抗體特性表達率(Qp)較低,較低的Cellboost7a/7b補料量在細胞代謝和細胞生長,產物表達等表現更好。
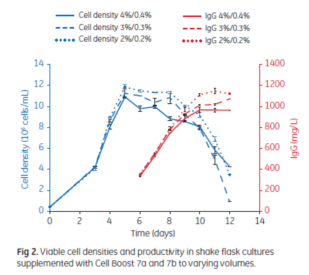
圖 2 ActiPro作為基礎培養基,不同 Cellboost7a/7b 補料策略的細胞生長及抗體表達情況
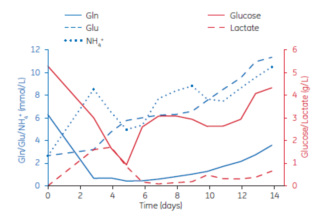
圖 3 ActiPro作為基礎培養基, d3 開始每天分別補充 Cellboost7a/7b 2%/0.2% 的細胞代謝情況
03培養溫度控制策略培養溫度是細胞培養最重要的製程參數之一,與其他製程參數(例如 pH 值,溶氧和二氧化碳分壓)相比,培養溫度更易於控制。工業生產中CHO細胞的饋料批次培養製程,很多時候會採用
降溫控制策略(Temperature shift,TS)。
-- 降溫控制策略 TS在批次培養的對數生長期採用 37°C 左右的生理溫度使細胞快速生長,儘快達到足夠細胞密度以生產抗體等產物。而在細胞進入對數後期及產物蛋白表達的平臺期,通過較低的次優培養溫度,使細胞停滯於G1期降低細胞凋亡率,來延長細胞維持較高活細胞密度的培養時間,以獲得更多的產物蛋白。
乳酸代謝對培養溫度也很敏感,通常認為細胞培養過程中改變培養溫度,可能是乳酸由生成向消耗轉移的觸發因素之一。
但是在實際製程開發中,會發現隨著低溫相所採用培養溫度的升高,會加速乳酸的消耗。比如在降溫後溫度高於 34°C 的條件下,乳酸代謝轉移發生較早,而且乳酸峰值較低,而當溫度降低至低於 33°C 時,則乳酸峰值濃度更高,代謝轉移發生較晚。因此在採用降溫處理時應兼顧乳酸代謝情況。
此外需要注意的是,CHO 細胞培養中的降溫策略對關鍵品質屬性(聚集體,電荷異構體,N-糖基化和宿主細胞殘留蛋白)的影響,進行降溫控制時必須同時考慮產物表達和產物品質屬性。這種溫度控制策略對細胞的生長、代謝,產物表達及產品品質的影響具有細胞系特異性。
因而在實際製程開發中需要針對不同細胞克隆對降溫策略進行優化,包括降温开始时间,降温度幅度,采用逐步降温还是一步到位降温方法等。
04培養環境的 pH理想中的 pH 值應在整個培養過程中保持恒定,不需要通過酸性或鹼性試劑進行調節。
但實際情況不可能如此,在饋料批次培養過程中乳酸的產生會導致 pH 下降,過低的 pH 抑制細胞的增殖,需要通過添加堿劑進行調節。
滲透壓增加通常是 pH 控制策略欠佳的結果。
依據克隆和細胞類型的不同,哺乳動物細胞培養中的最低 pH 極限通常在 6.6–6. 8 之間。許多生物製程都始于高 pH 值,培養過程中逐步降低。但是培養過程中 pH 值降低的速度往往不足以阻止乳酸的積累。
在適合細胞生長的範圍內,偏高的培養環境 pH 通常與更快細胞的代謝速率相關,因此在細胞培養製程開發中,有時會通過在較低 pH 下操作,以抑制細胞增殖為代價來限制乳酸的產生。
而且 pH 值有時會與抗體產品的品質相關,此時需要同時兼顧乳酸代謝和產品品質。因此迄今為止,對於饋料批次培養製程中的 pH 控制方式仍然沒有固定的策略。
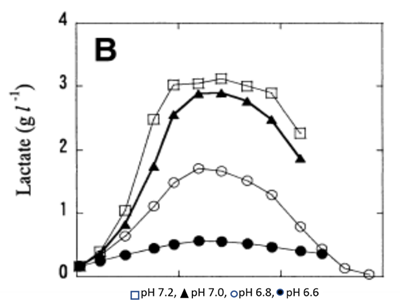
圖 4 饋料批次培養中環境 pH 對乳酸代謝的影響情況
05 CO2分壓與小規模培養相比,乳酸的產生通常會隨著培養規模的擴大而增加,大規模培養時乳酸消耗的代謝轉變減少或完全不發生。引起這種現象的原因可能與不同規模生物反應器的氣體交換特點相關,比如小體積反應器的 CO2 排出效率遠遠高於大體積反應器,目前已發現培養製程中的 pCO2 可能會影響乳酸的產生。
有研究發現,在饋料批次培養過程中 pCO2 控制在 12.5% 時,乳酸可以在培養中由生成轉變為消耗;而當 pCO2 升高為 20% 時,整個饋料批次培養過程中都有乳酸生成。
進一步研究發現,代謝轉移發生前後 CO2 分壓對細胞代謝的影響是不同的。代謝轉移發生前,pCO2 升高時細胞的單位氧消耗率下降,表明此條件下細胞的氧化能力較弱,因此引起乳酸持續生成。而代謝轉移發生後,不同 pCO2 條件下細胞的平均耗氧量和細胞生長的平均速率相似。但是較低 pCO2 條件下,葡萄糖消耗量更低,細胞更傾向於消耗乳酸和氨。
目前認為乳酸代謝轉移前細胞的代謝差異,是引起饋料批次培養過程中乳酸代謝差異的主要原因,而代謝轉移發生後的細胞代謝差異在某種程度上可能是乳酸代謝差異的結果。不同pCO
2條件下,pH值曲線差異輕微但滲透壓濃度卻可能差異巨大。較高pCO
2條件下的滲透壓往往更高,進一步影響細胞代謝。
對於 pCO
2 對細胞乳酸代謝影響的機制還無法確切解釋,目前認為可能與 CO
2/HCO
3- 參與酶促反應調節相關。
在饋料批次培養中通過降低的CO2/HCO3- 濃度,可促進乳酸向消耗代謝方向轉變,對於緩解或解決大規模饋料批次培養或灌流培養時的乳酸堆積具有重要意義。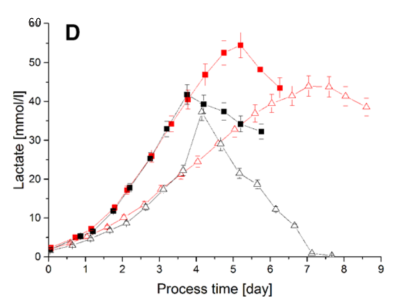
圖 5 饋料批次培養中不同 pCO
2 條件下的乳酸代謝情況
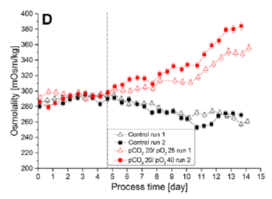
圖 6 饋料批次培養中不同 pCO
2 條件下的滲透壓變化情況
本文簡要介紹了CHO細胞作為宿主表達重組蛋白和單抗的饋料批次培養中乳酸代謝,及其代謝轉移的影響及控制因素,以在饋料批次培養製程的建立中提供細胞代謝層面的理論依據。
封面圖.png)
小標題圖.png)
小標題圖.png)
小標題圖.png)
小標題圖.png)
標一.png)
小標題圖.png)
圖一.png)
圖2.png)
圖3.png)
圖4.png)
圖5.png)
原來的表3.png)
小標題圖.png)











