2021/07/07 關於血清的那些事兒(三):和血清熱去活化說 No
血清熱去活化,是每個細胞培養者經常遇到的話題。
血清熱去活化是什麼?
是否每種細胞培養都需要熱去活化的血清?
血清該如何熱去活化?
From an Art to a Science,
讓我們以科學的眼光來審視血清去活化。
去活化是一個應用到哺乳動物細胞培養的血清加工過程,即將血清在 56℃ 下加熱30分鐘。HyClone 作為一家血清供應商,經常被問到,是否必須熱去活化?熱去活化的目的是什麼?這篇文章中,我們解釋了熱去活化的原因以及熱去活化並不適合大部分細胞的培養。比較不同細胞株在血清中的生長性能,結果表明經熱滅活處理的血清並未表現出任何優勢,且會影響多種細胞的生長即血清熱去活化是非必須的。
一、簡介
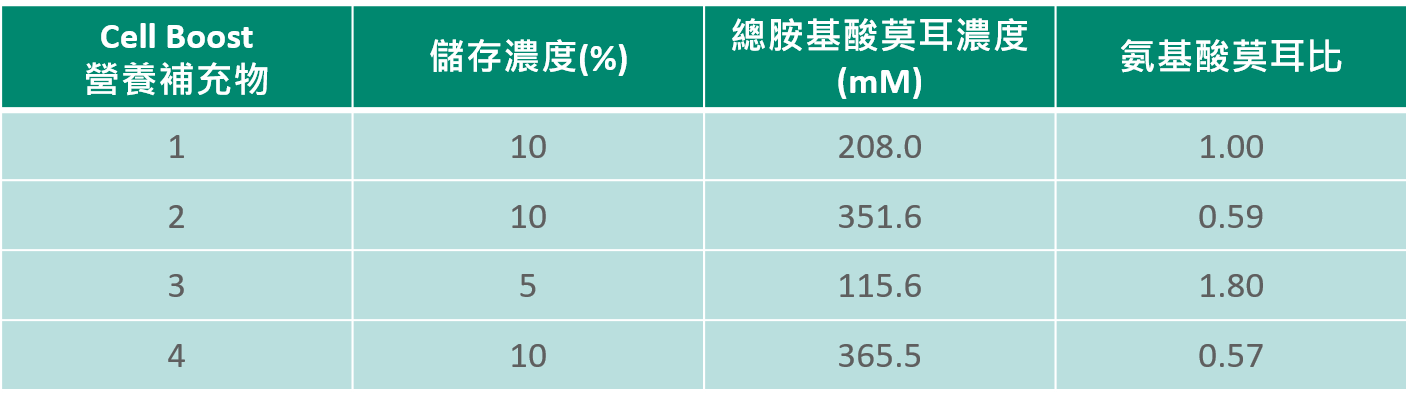
在細胞培養中,血清熱去活化是許多培養者非常感興趣的話題。價格不菲的血清中含有諸如生長因數,維生素,氨基酸等珍貴物質,將它們置於 50℃ 以上,溫度長達30分鐘是完全沒有必要的。儘管如此,有些實驗室還是把胎牛血清熱去活化作為常規步驟來執行。多數實驗者並未考慮這種極端的處理會影響生長因素、維生素、氨基酸及其類似物的活性。我們的技術支援中最常被提到的問題是是否該對血清進行熱去活化,下面我們就對胎牛血清的熱去活化進行探討和解釋。
據調查,至少70%的研究者對血清熱去活化僅僅是因為遵照常規操作,或者說認為是理所當然的。常規熱去活化建議的溫度在 45-62℃之間,時間為15-60分鐘不等。其中最常用方法是56℃處理30分鐘。這些基本上都來源於二十世紀70年代之前,且從未被質疑。隨著血清採集、處理、加工製程的改進及提高,許多早先認為是熱去活化的原因早已不再成立。只有少數對血清進行熱去活化的研究者在實驗中證實了這一步驟的有效性和必要性。
熱去活化目的是為了去除血清中補體等對熱敏感的物質,但是在胎牛血清中對補體的去活化明顯沒有必要。Triglia and Linscott 曾測定了商業血清中的補體成分 [1],他們發現胎牛血清中 C3 和 C6 的含量僅為成年動物血清的 1-3%,除主要補體 C3 之外,其它補體成分僅有成年動物的 5-50%,而 C3 在胎牛血清中幾乎不能檢出。通過補體固定實驗,我們也在多個不同批次的胎牛血清中獲得了相似的結果。即使在未稀釋的血清中,也未發現有明顯的溶血現象。另外,多數實驗室在培養前對培養液進行 37℃ 預熱的過程,對熱敏感的補體也有去活化的作用。
除了對補體去活化以外,熱處理也對血清中可能存在的黴漿菌具有去活化作用。多年以前,採用 450 nm孔徑的濾膜過濾加工血清時,血清中的黴漿菌污染時有發生。針對這個問題,HyClone 首家使用 100 nm 三層濾膜連續濾過技術,自從採用這項技術以及後來的 40 nm 濾過技術之後,我們的血清產品再沒有發現黴漿菌污染。持續的改進和驗證,完全消除了依靠熱去活化處理黴漿菌的顧慮,也使得熱去活化成為不必要的另外一個原因。
Pinyopummintr 等證明不進行熱去活化不影響牛胚胎細胞的發育 [2]。又有研究結果證實熱去活化步驟會減弱胎牛血清和小牛血清對細胞的促貼附作用 [3]。使用 SV-BHK, BALB-3T3, CV-1 和 FS-4 做細胞貼附實驗,熱去活化對胎牛血清的影響小於小牛血清。當細胞附著後,熱去活化的血清並不影響細胞的生長。針對昆蟲細胞和桿狀病毒的表達,據報導,熱去活化是沒有必要的 [4]。
二、血清熱去活化對細胞生長的影響
我們調查了熱滅活對胎牛血清及不同細胞株生長能力的影響。
表 1 詳細描述了血清熱去活化的步驟。通過比較 11 種細胞株在未處理和熱去活化血清的生長情況(見圖1)。
(1) 6 種細胞株(HBAE, MDBK、Vero, HFS(Human Foreskin Fibroblast), MRC-5 和 Mv.1.Lu)帶來負面影響;
(2) 3 種細胞株(FOX-NY, MDCK 和 CHO-K1)不受熱滅去活化的影響;
(3) 2 種細胞株(Balb/3T3 和 Sp2/0-Ag14 hybrid)的生長有輕微提高。
所以,在正常的操作下,熱滅活對細胞的生長沒有明顯促進作用,通常會導致生長率下降。
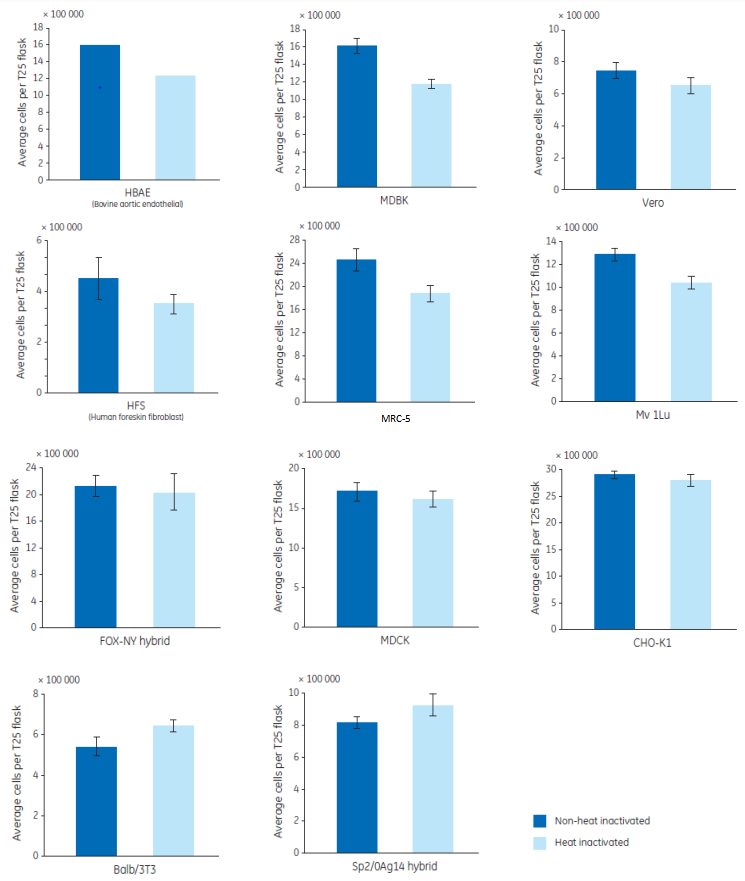
圖 1. 11 種細胞株在未處理和熱去活化血清中的生長情況
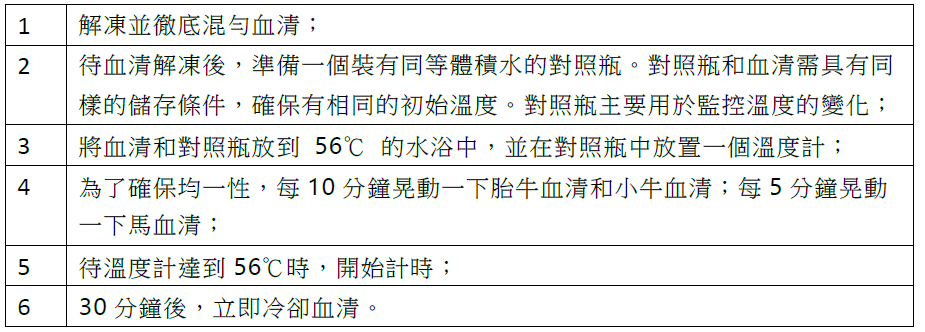
表 1. 血清熱去活化的步驟
若操作不正確,熱去活化經常給血清產品帶來不可逆的影響。
加熱血清導致血清中產生沉澱,而這些經常被認為是微生物污染。當注意到這個現象之後,為了驗證污染的存在,或者促進沉澱的溶解,許多培養者往往將血清放置 37℃ 培養。不幸的是,這會使情況變得更糟,進一步增加血清中的沉澱。甚至有經驗的培養者和微生物學家也無法辨別兩者的區別。為了確定血清未被污染,大量的實驗如鏡檢、無菌培養試驗和革蘭氏染色等等更是浪費了實驗者大量的時間和精力。56℃處理30分鐘的熱去活化和解凍過程中不適當的混勻都會導致沉澱的形成。
56℃
熱去活化最常用的溫度是56℃,但有些操作規定要求更高的溫度,這不但進一步影響血清促生長能力,同時還會產生更多沉澱。65℃處理30分鐘的熱去活化顯著降低了 MRC-5 和 MDBK 的生長。雖然 Sp2/0-Ag14 hybrid 的生長未受影響,但無法支持 HBAE 的培養(見圖 2.)。
總時間
不管你有意還是無意,血清產品經常會暴露在更高溫度超過 30 分鐘。比如將血清誤放在水浴中隔夜。延長熱去活化的時間同樣會增加血清中沉澱的形成,降低血清促生長的性能。血清在 56℃ 下熱處理 30、75、120 和 1080 分鐘,並培養 HBAE, MRC-5, MDBK 和 Sp2/0-Ag14 hybrid 四種細胞(結果見圖 3)。隨著熱處理時間的延長,HBAE, MRC-5 和 MDBK 細胞的生長狀態逐漸減低。HBAE 細胞對熱去活化的血清較敏感,無法在熱處理1080分鐘的血清中生長。和提高熱處理溫度一樣,隨著熱處理時間的延長,Sp2/0-Ag14 hybrid 的生長未受影響。
許多因素都會影響血清熱處理的總時間。
(1) 玻璃瓶和塑膠瓶(PETG)具有不同熱容量,這直接影響加熱速率。為了減少破損,便於儲存,塑膠瓶基本上取代了硼矽酸鹽玻璃瓶。但塑膠瓶裝物加熱到 56℃ 所用的時間會增加 30% ,同樣會延長其內容物冷卻時間。
(2) 熱去活化之後血清的冷卻速率與媒介有關,如是放置於冰箱、冰櫃還是冰浴中(見圖 4)。當熱去活化的血清溫度從 56℃ 降到 10℃,冰浴冷卻只需要 30分鐘,而在冰箱中冷卻需要330分鐘。為了促進血清的加熱和冷卻可將其等分為小體積。
(3) 水浴中的水位也會影響血清加熱的速率。由於瓶子易漂浮,不適合將水浴灌滿使水位達到瓶裝血清的刻度。可採用在瓶口套一個商業化鉛塊的方式來阻止瓶子漂浮。圖 5 呈現了水位達到塑膠瓶 300 mL 和 500 mL 刻度時的加熱速率。當水位達到 500 mL 刻度線時,40分鐘就可以達到 56℃,而水位到達 300 mL 時,則需要60分鐘,增加了高溫處理的時間。
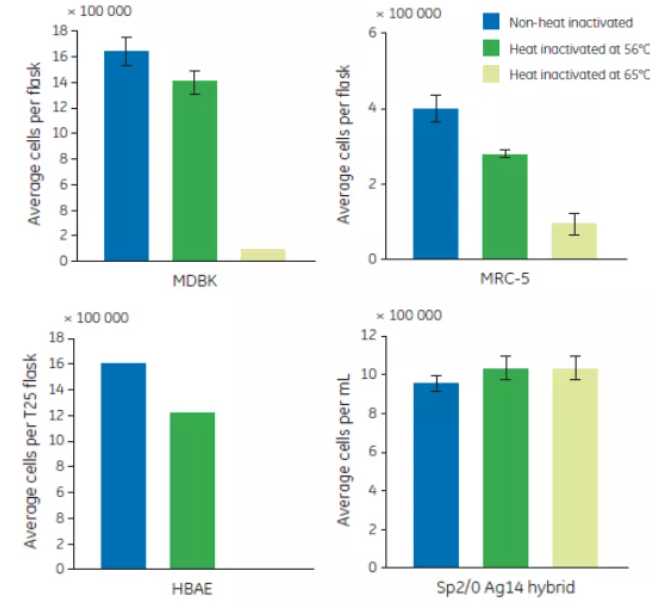
圖 2. 4 種細胞株在 56℃ 和 65℃ 熱處理血清中的生長情況
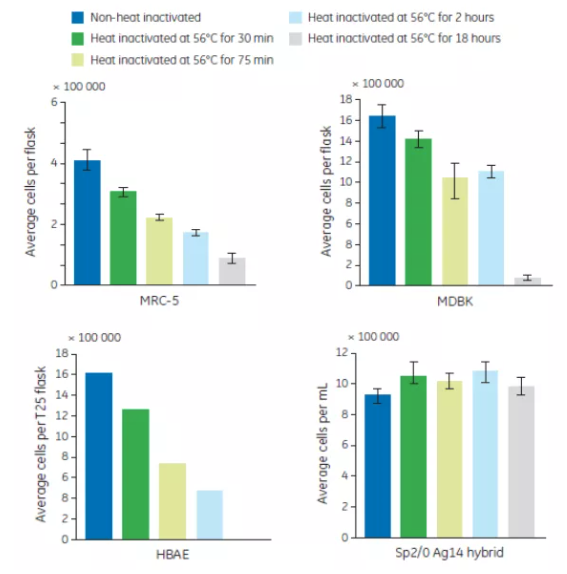
圖 3. 延長血清熱去活化時間對 4 種細胞生長的影響
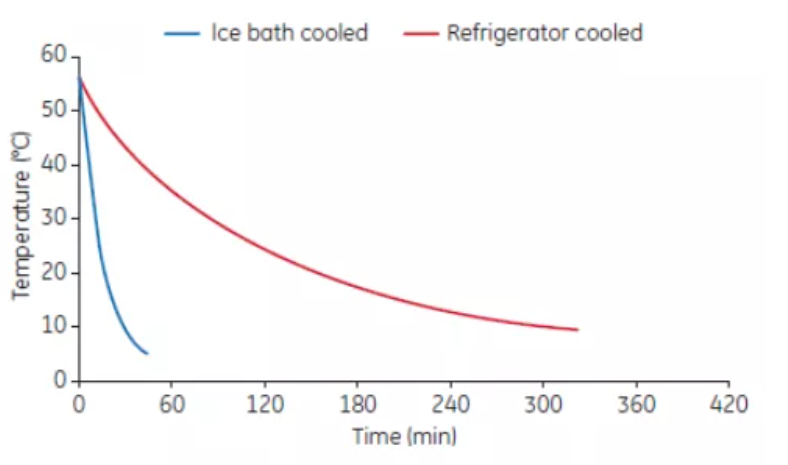
圖 4. 血清在冷浴或冰箱中的冷卻速率
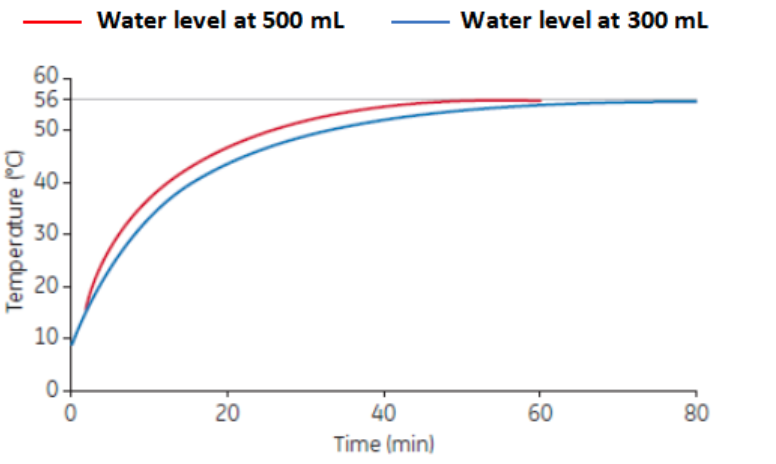
圖 5. 不同水位(300 mL 和 500 mL)下的加熱速率
總之,多數細胞培養中血清的熱去活化並不是必要的。許多情況下,血清熱去活化並不會改善細胞的生長性能,可能還會帶來負面影響。即使對少數細胞有促進作用,其促進的效果也微不足道。另外,血清的熱去活化會產生沉澱,這常常被認為是微生物污染,給用戶和供應商帶來不必要的麻煩。我們建議,那些進行血清熱去活化的用戶,針對其使用的細胞或培養系統,需要通過試驗來證實其必要性。與建議的傳統熱去活化溫度和時間相比,在實際操作過程中,我們經常會無意間會將血清加熱到更高的溫度,延長加熱的時間。如果血清熱去活化是必須的,需要嚴格監測並選擇一個可重複的方案操作。
参考文献:
1. Triglia,R.P., Linscott,W.D. Titers of nine complement components, conglutinin and C3b-inactivator in adult and fetal bovine sera. Mol Immunol 17, 741-748 (1980).
2. Pinyopummintr,T., and Bavister,B.D. Development of bovine embryos in a cell-free culture medium: effects of type of serum, timing of its inclusion and heat inactivation. Theriogenology. 41, 1241-1249 (1994).
3. Giard, D.J. Routine heat inactivation of serum reduces its capacity to promote cell attachment. In Vitro Cellular & Developmental Biology 23, 691-697 (1987).
4. Invitrogen. Expressions 2, p11 (1995).
血清熱去活化是什麼?
是否每種細胞培養都需要熱去活化的血清?
血清該如何熱去活化?
From an Art to a Science,
讓我們以科學的眼光來審視血清去活化。
去活化是一個應用到哺乳動物細胞培養的血清加工過程,即將血清在 56℃ 下加熱30分鐘。HyClone 作為一家血清供應商,經常被問到,是否必須熱去活化?熱去活化的目的是什麼?這篇文章中,我們解釋了熱去活化的原因以及熱去活化並不適合大部分細胞的培養。比較不同細胞株在血清中的生長性能,結果表明經熱滅活處理的血清並未表現出任何優勢,且會影響多種細胞的生長即血清熱去活化是非必須的。
一、簡介
在細胞培養中,血清熱去活化是許多培養者非常感興趣的話題。價格不菲的血清中含有諸如生長因數,維生素,氨基酸等珍貴物質,將它們置於 50℃ 以上,溫度長達30分鐘是完全沒有必要的。儘管如此,有些實驗室還是把胎牛血清熱去活化作為常規步驟來執行。多數實驗者並未考慮這種極端的處理會影響生長因素、維生素、氨基酸及其類似物的活性。我們的技術支援中最常被提到的問題是是否該對血清進行熱去活化,下面我們就對胎牛血清的熱去活化進行探討和解釋。
據調查,至少70%的研究者對血清熱去活化僅僅是因為遵照常規操作,或者說認為是理所當然的。常規熱去活化建議的溫度在 45-62℃之間,時間為15-60分鐘不等。其中最常用方法是56℃處理30分鐘。這些基本上都來源於二十世紀70年代之前,且從未被質疑。隨著血清採集、處理、加工製程的改進及提高,許多早先認為是熱去活化的原因早已不再成立。只有少數對血清進行熱去活化的研究者在實驗中證實了這一步驟的有效性和必要性。
熱去活化目的是為了去除血清中補體等對熱敏感的物質,但是在胎牛血清中對補體的去活化明顯沒有必要。Triglia and Linscott 曾測定了商業血清中的補體成分 [1],他們發現胎牛血清中 C3 和 C6 的含量僅為成年動物血清的 1-3%,除主要補體 C3 之外,其它補體成分僅有成年動物的 5-50%,而 C3 在胎牛血清中幾乎不能檢出。通過補體固定實驗,我們也在多個不同批次的胎牛血清中獲得了相似的結果。即使在未稀釋的血清中,也未發現有明顯的溶血現象。另外,多數實驗室在培養前對培養液進行 37℃ 預熱的過程,對熱敏感的補體也有去活化的作用。
除了對補體去活化以外,熱處理也對血清中可能存在的黴漿菌具有去活化作用。多年以前,採用 450 nm孔徑的濾膜過濾加工血清時,血清中的黴漿菌污染時有發生。針對這個問題,HyClone 首家使用 100 nm 三層濾膜連續濾過技術,自從採用這項技術以及後來的 40 nm 濾過技術之後,我們的血清產品再沒有發現黴漿菌污染。持續的改進和驗證,完全消除了依靠熱去活化處理黴漿菌的顧慮,也使得熱去活化成為不必要的另外一個原因。
Pinyopummintr 等證明不進行熱去活化不影響牛胚胎細胞的發育 [2]。又有研究結果證實熱去活化步驟會減弱胎牛血清和小牛血清對細胞的促貼附作用 [3]。使用 SV-BHK, BALB-3T3, CV-1 和 FS-4 做細胞貼附實驗,熱去活化對胎牛血清的影響小於小牛血清。當細胞附著後,熱去活化的血清並不影響細胞的生長。針對昆蟲細胞和桿狀病毒的表達,據報導,熱去活化是沒有必要的 [4]。
二、血清熱去活化對細胞生長的影響
我們調查了熱滅活對胎牛血清及不同細胞株生長能力的影響。
表 1 詳細描述了血清熱去活化的步驟。通過比較 11 種細胞株在未處理和熱去活化血清的生長情況(見圖1)。
(1) 6 種細胞株(HBAE, MDBK、Vero, HFS(Human Foreskin Fibroblast), MRC-5 和 Mv.1.Lu)帶來負面影響;
(2) 3 種細胞株(FOX-NY, MDCK 和 CHO-K1)不受熱滅去活化的影響;
(3) 2 種細胞株(Balb/3T3 和 Sp2/0-Ag14 hybrid)的生長有輕微提高。
所以,在正常的操作下,熱滅活對細胞的生長沒有明顯促進作用,通常會導致生長率下降。

圖 1. 11 種細胞株在未處理和熱去活化血清中的生長情況
表 1. 血清熱去活化的步驟

若操作不正確,熱去活化經常給血清產品帶來不可逆的影響。
加熱血清導致血清中產生沉澱,而這些經常被認為是微生物污染。當注意到這個現象之後,為了驗證污染的存在,或者促進沉澱的溶解,許多培養者往往將血清放置 37℃ 培養。不幸的是,這會使情況變得更糟,進一步增加血清中的沉澱。甚至有經驗的培養者和微生物學家也無法辨別兩者的區別。為了確定血清未被污染,大量的實驗如鏡檢、無菌培養試驗和革蘭氏染色等等更是浪費了實驗者大量的時間和精力。56℃處理30分鐘的熱去活化和解凍過程中不適當的混勻都會導致沉澱的形成。
56℃
熱去活化最常用的溫度是56℃,但有些操作規定要求更高的溫度,這不但進一步影響血清促生長能力,同時還會產生更多沉澱。65℃處理30分鐘的熱去活化顯著降低了 MRC-5 和 MDBK 的生長。雖然 Sp2/0-Ag14 hybrid 的生長未受影響,但無法支持 HBAE 的培養(見圖 2.)。
總時間
不管你有意還是無意,血清產品經常會暴露在更高溫度超過 30 分鐘。比如將血清誤放在水浴中隔夜。延長熱去活化的時間同樣會增加血清中沉澱的形成,降低血清促生長的性能。血清在 56℃ 下熱處理 30、75、120 和 1080 分鐘,並培養 HBAE, MRC-5, MDBK 和 Sp2/0-Ag14 hybrid 四種細胞(結果見圖 3)。隨著熱處理時間的延長,HBAE, MRC-5 和 MDBK 細胞的生長狀態逐漸減低。HBAE 細胞對熱去活化的血清較敏感,無法在熱處理1080分鐘的血清中生長。和提高熱處理溫度一樣,隨著熱處理時間的延長,Sp2/0-Ag14 hybrid 的生長未受影響。
許多因素都會影響血清熱處理的總時間。
(1) 玻璃瓶和塑膠瓶(PETG)具有不同熱容量,這直接影響加熱速率。為了減少破損,便於儲存,塑膠瓶基本上取代了硼矽酸鹽玻璃瓶。但塑膠瓶裝物加熱到 56℃ 所用的時間會增加 30% ,同樣會延長其內容物冷卻時間。
(2) 熱去活化之後血清的冷卻速率與媒介有關,如是放置於冰箱、冰櫃還是冰浴中(見圖 4)。當熱去活化的血清溫度從 56℃ 降到 10℃,冰浴冷卻只需要 30分鐘,而在冰箱中冷卻需要330分鐘。為了促進血清的加熱和冷卻可將其等分為小體積。
(3) 水浴中的水位也會影響血清加熱的速率。由於瓶子易漂浮,不適合將水浴灌滿使水位達到瓶裝血清的刻度。可採用在瓶口套一個商業化鉛塊的方式來阻止瓶子漂浮。圖 5 呈現了水位達到塑膠瓶 300 mL 和 500 mL 刻度時的加熱速率。當水位達到 500 mL 刻度線時,40分鐘就可以達到 56℃,而水位到達 300 mL 時,則需要60分鐘,增加了高溫處理的時間。

圖 2. 4 種細胞株在 56℃ 和 65℃ 熱處理血清中的生長情況

圖 3. 延長血清熱去活化時間對 4 種細胞生長的影響

圖 4. 血清在冷浴或冰箱中的冷卻速率

圖 5. 不同水位(300 mL 和 500 mL)下的加熱速率
總之,多數細胞培養中血清的熱去活化並不是必要的。許多情況下,血清熱去活化並不會改善細胞的生長性能,可能還會帶來負面影響。即使對少數細胞有促進作用,其促進的效果也微不足道。另外,血清的熱去活化會產生沉澱,這常常被認為是微生物污染,給用戶和供應商帶來不必要的麻煩。我們建議,那些進行血清熱去活化的用戶,針對其使用的細胞或培養系統,需要通過試驗來證實其必要性。與建議的傳統熱去活化溫度和時間相比,在實際操作過程中,我們經常會無意間會將血清加熱到更高的溫度,延長加熱的時間。如果血清熱去活化是必須的,需要嚴格監測並選擇一個可重複的方案操作。
参考文献:
1. Triglia,R.P., Linscott,W.D. Titers of nine complement components, conglutinin and C3b-inactivator in adult and fetal bovine sera. Mol Immunol 17, 741-748 (1980).
2. Pinyopummintr,T., and Bavister,B.D. Development of bovine embryos in a cell-free culture medium: effects of type of serum, timing of its inclusion and heat inactivation. Theriogenology. 41, 1241-1249 (1994).
3. Giard, D.J. Routine heat inactivation of serum reduces its capacity to promote cell attachment. In Vitro Cellular & Developmental Biology 23, 691-697 (1987).
4. Invitrogen. Expressions 2, p11 (1995).